La lettura della pandemia da Covid-19 fa dubitare delle strategie attuate finora per affrontare le emergenze sanitarie. Il Piano Pandemico è basato su un presupposto empirico che non trova riscontro nelle evidenze scientifiche e suggerisce di aggiornare il modello di intervento emergenziale.
Il Piano Pandemico
Nel corso della storia, il mondo è stato colpito da diverse pandemie che hanno causato ragguardevoli perdite umane. La peste nera nel 1350 ridusse l’Europa da 80 a 30 milioni; il vaiolo, endemico in Europa e Asia, dopo la scoperta dell’America ne decimò la popolazione, la spagnola nel 1918 provocò 20 milioni di morti.
La penicillina fu scoperta nel 1928 ma commercializzata nel ’43, lasciando aperto il fronte virale, contro cui c’era un’unica arma: il vaccino. Inventato nel 1796 per il vaiolo, nel 1888 fu reso obbligatorio in Italia. Imposto in molti Paesi, non tardarono i successi: nel maggio 1979 l’OMS dichiarava eradicato il virus.
L’Organizzazione Mondiale della Sanità (OMS) è stata fondata nel 1948 per gestire le malattie infettive, diventando il punto di riferimento per la sorveglianza e la preparazione contro le pandemie. L’OMS monitora i virus ed elabora un piano di rilevazione epidemiologica e virale mondiale approntando ogni anno un vaccino (1) per contenere l’impatto dell’influenza.
Nel 2003 il virus dell’influenza aviaria A/H5N1, endemico nei volatili dell’estremo oriente, causò gravi infezioni anche negli uomini. Ne derivò il Piano di Preparazione all’Influenza Globale, detto Piano Pandemico (PP), presentato nel 2005. Raccomandava “a tutti i Paesi di mettere a punto un PP e di aggiornarlo costantemente seguendo linee guida concordate” (2) e di organizzare un sistema di Sorveglianza Epidemiologica e Virologica (SEeV).
Sorveglianza Epidemiologica e Virologica in Italia
In Italia, la SEeV per l’influenza è stata avviata nel 1999-2000 dall’Istituto Superiore di Sanità (ISS): InfluNet coinvolge medici di base, pediatri – sentinelle, circa 1000 – e i Laboratori delle ASL, delle Regioni, e del Centro Nazionale per l’Influenza, per monitorare l’inizio, la durata e l’intensità dell’influenza, nonché la circolazione dei diversi ceppi virali. Le sentinelle segnalano i casi di sindrome simil-influenzale (influenza- like illness, ILI) e, dal 2010, anche le ARI (Acute Respiratory Infection) dalla 42° settimana dell’anno fino alla 17° del successivo.
I criteri per diagnosticare una ILI sono “almeno uno tra i seguenti sintomi generali: febbre o febbricola, malessere/spossatezza, mal di testa, dolori muscolari; almeno uno tra i seguenti sintomi respiratori: tosse, mal di gola, respiro affannoso”.
I criteri per stabilire se un virus può dar luogo ad una pandemia (3), indicati dall’OMS e rielaborati da ogni Stato (4), si basano soprattutto sulla contagiosità.
Contagiosità e rilevanza delle infezioni asintomatiche
La misurazione della contagiosità di un virus è essenziale per valutare il suo impatto; è misurata dal Rt ma solo sui sintomatici, come spiega l’ISS: “Perché calcoliamo Rt solo sui sintomatici? (5)… l’individuazione delle infezioni asintomatiche dipende molto dalla capacità di effettuare screening. Il risultato è che un maggiore o minore aumento dei casi asintomatici trovati, non dipende dalla trasmissibilità del virus ma dal numero di analisi effettuate”.
Tuttavia, la sorveglianza basata solo sui casi sintomatici può non essere sufficiente per individuare le infezioni asintomatiche e le persone nel periodo di latenza. Per il Covid, in Italia, fino a dicembre ’21, venivano testati sintomatici e loro contatti, dall’inizio del ‘22 i tamponi sono stati liberalizzati. La figura 1 mostra l’incidenza dei contagi prima e dopo (linea nera) la liberalizzazione dei tamponi.

Figura 1
La sorveglianza basata solo sui casi sintomatici potrebbe non essere sufficiente per individuare le infezioni asintomatiche e le persone nel periodo di latenza. L’ampliamento dei test ha permesso di identificare casi asintomatici e presintomatici, rivelando che la contagiosità del virus era più elevata nei 2-3 giorni precedenti e successivi all’insorgenza dei sintomi (6). Pertanto, è diventato importante testare non solo i casi sintomatici, ma anche quelli asintomatici, per interrompere la catena di trasmissione.
Diversità dei virus coinvolti nelle pandemie
Durante il periodo della pandemia H1N1 (da 11-06-2009 a 06-08-2010) era in corso a Glasgow uno studio virologico (7) che ha testato 44.230 casi di infezioni delle vie respiratorie contratte dal 2005 al 2013, con un test multiplex che identificava 11 virus. Questi i risultati:

L’influenza è data da un insieme di virus diversi, anche sconosciuti (in grigio).
Con test multiplex sono stati indagati anche, in uno studio condotto durante la pandemia Covid (8) i pazienti con sintomi di infezione delle vie respiratorie (ARI) che nella stagione 2020-21 risultavano negativi al tampone per Cov19.

Il multiplex comprende 18 virus e 4 batteri; il 63,7% dei malati era negativo ai germi testati, mentre in molti casi sono state rilevate coinfezioni (A). Il rinovirus risulta essere il virus più frequente, mentre FLU A-B (virus influenzali propriamente detti) sono presenti solo nel 2.8% dei pazienti, per merito del vaccino.
Gli studi condotti durante la pandemia di H1N1 e Covid-19 hanno rilevato la presenza di numerosi virus respiratori partendo da sintomi influenzali.
Vaccini
Nella pratica clinica di fronte a sintomi da raffreddamento la diagnosi resta raffreddore, presumendo un rinovirus. Analogamente per prevenire l’influenza si vaccina contro il virus influenzale che nella stagione 2022-23, in Italia, è stato trovato nel 21,8% degli influenzati. Il vaccino antinfluenzale è adeguato solo per 1 su 5 persone! Sull’efficacia del vaccino non ci sono dati italiani perché: “L’attuale sistema di raccolta dati InfluNet/RespiVirNet è stato disegnato originariamente per ottenere informazioni relative ai virus influenzali. La rilevazione degli altri virus respiratori nei campioni prelevati, partita a novembre 2022, non è attualmente effettuata in modo uniforme in tutti i laboratori aderenti alla rete. Possono pertanto verificarsi piccole distorsioni nel calcolo …” (grassetto e corsivo miei). Nonché alcune settimane sono accompagnate dall’avvertenza “Si sottolinea che l’incidenza osservata in alcune regioni è fortemente influenzata dal ristretto numero di medici e pediatri che hanno inviato, al momento, i loro dati.” (grassetto originale).
Poiché l’odd ratio – e di conseguenza l’efficacia – è calcolata sulla percentuale di influenzati vaccinati, non potendo avere stime precise della incidenza dei virus influenzali propriamente detti, è prudente non calcolarla. Mentre negli USA l’efficacia dei vaccini è misurata dalla stagione 2004-2005. Nella stagione 2021-22 è stata del 36%.
Si deve concludere che il vaccino ha scarsa efficacia? Al contrario: nella stagione 20-21 (l’anno del lockdown) fra i campioni esaminati dalla SEeV-Italia, non c’era nessun positivo per il virus influenzale. Nel mondo non è andata diversamente: su un totale di 682.485 campioni, 791 positivi. Il vaccino funziona ma l’influenza, dovuta ad altri germi, c’è stata lo stesso, anche se attenuata dalle misure pandemiche.
Abbiamo già considerato come nei vari studi eseguiti in multiplex il rinovirus risulta il virus che dà più sindromi influenzali (Figura 1) e infezioni delle vie respiratorie (Figura 2), mentre FLU A-B sono rari, grazie al vaccino. Più l’OMS riesce ad individuare le varianti più aggressive e più funziona: negli anni 2017-18 e 2018-19 l’efficacia del vaccino è stata rispettivamente del 36 e del 47%.
Stagionalità
La SEeV presuppone che l’influenza ha una sua stagionalità, quindi nei primi 2 anni della pandemia (19-20 e 20-21) sono stati testati solo i casi sospetti, con sintomi simil-influenzali e nelle due stagioni estive i contagi crollavano.
Applicando queste regole d’ingaggio, la stagionalità del covid risultava molto simile a quella dell’influenza.
Da Gennaio 2022, liberalizzati i tamponi, la situazione, da inizi giugno fino ad inizi settembre del 2020 vs. 2022 appariva così:
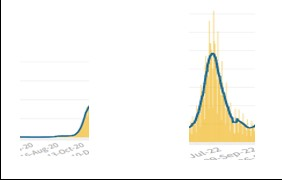
È emerso da studi precedenti (9), ed è stato confermato anche da un recente studio pubblicato su Nature, che il Covid-19 non segue un modello stagionale fisso e si presenta in stagioni diverse con sintomi diversi. Durante i primi due anni, l’approccio di testare solo i pazienti con sintomi influenzali ha comportato che il virus si sia diffuso durante l’estate con sintomi più simili a un raffreddore, evitando così di essere riconosciuto dai test. Pertanto, non è stato possibile identificare il Covid-19 a settembre, ma solo a novembre, quando i sintomi sono cambiati con l’arrivo di una nuova stagione e il virus si è presentato nuovamente con sintomi influenzali. A quel punto, i pazienti venivano sottoposti al test per il Covid-19.
Mortalità
Il bilancio finale del covid è di quasi 7 milioni di morti in tutto il mondo contro un bilancio annuale dell’influenza, nel complesso, inferiore, come spiega l’Istituto Superiore di Sanità riguardo alla necessità di contrastare l’influenza: “Le infezioni respiratorie acute causate dai virus influenzali possono essere lievi, gravi e possono persino causare la morte nei soggetti a rischio come anziani e bambini. Si stima che le epidemie annuali causino da 3 a 5 milioni di casi severi di influenza e da 290.000 a 650.000 morti in tutto il mondo.”
La curva di mortalità per età del Cov19 in Italia è completamente diversa dalle precedenti e segue solo una crescita per età:

La distribuzione delle vittime del Covid è legata all’età come quella delle morti per tutte le cause:
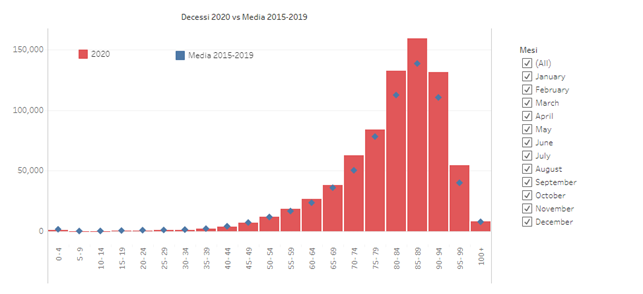
Il grafico mostra le morti per tutte le cause divise per lustri di età nel primo anno del Covid rispetto alla media dei 5 anni precedenti: mentre fino ai settant’anni non ci sono incrementi di mortalità, dai 70 ai 100 anni l’incremento è netto. Lo scostamento netto e continuo è solo dopo gli ottanta anni.
In Italia su ca. 60 milioni di abitanti ci sono stati 26 milioni di contagi e 190.000 morti, l’85% dai 70 anni in su.
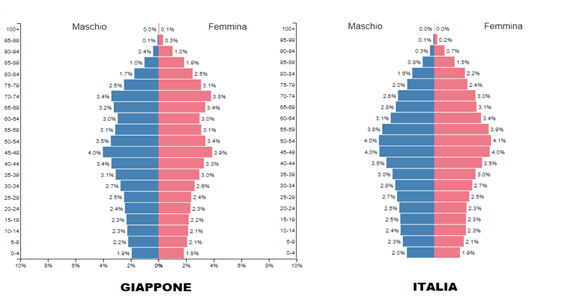
Invece in Giappone, su circa 125 milioni e una popolazione più anziana, 22 milioni di contagi e 46.000 morti, pur avendo attuato un PP più soft.
Nelle statistiche mondiali sulla mortalità per covid la nazione dell’UE con la maggiore mortalità è la Bulgaria, con una popolazione anziana paragonabile alle altre europee ma una aspettativa di vita più bassa. La contagiosità e la mortalità del Cov19 sono inversamente proporzionali all’aspettativa di vita. Ancora più specifica è l’aspettativa di salute: più questa è alta più è bassa la contagiosità e la mortalità.
In pratica, in Italia su 100 ultranovantenni che hanno contratto il Covid ne sono morti 13,2 mentre 86,8 – quelli con una maggiore aspettativa di vita e salute – l’hanno superata!
Differenze fra Covid-19 e le passate pandemie
L’11 giugno 2009 l’Oms dichiarò l’inizio della pandemia influenzale H1N1, raccomandando agli Stati di passare alla Fase 6 di allerta e il 6 agosto 2010 ne proclamò ufficialmente la fine, con queste cifre: casi confermati in tutto il mondo 1.632.710, decessi 18.449.
Ma non tutti concordano. Altri sostengono che contagi e decessi furono almeno 10 volte le cifre ufficiali, fino a chi stima che il numero di casi potrebbe essere compreso tra 700 milioni e 1.4 miliardi, dall’11 al 21 % dell’allora popolazione mondiale, di 6.8 miliardi. Perché opinioni così distanti? Cosa ne pensano le istituzioni competenti italiane? A detta dell’ISS: “Tuttavia, va sottolineato che mentre la maggior parte dei casi di influenza pandemica sono stati lievi, a livello mondiale si stima che la pandemia ha causato tra i 100.000 e i 400.000 morti nel solo primo anno”.
La più grande differenza fra le cifre ufficiali e le opinioni citate sta nel fatto che i casi dell’OMS sono comprovati dal test.
Un test specifico può condizionare i risultati, come già visto considerando lo studio di Glasgow (Fig. 2). Nel periodo in cui al test generico multiplex ne fu aggiunto uno specifico per la variante pandemica A H1N1 pdm09, i virus influenzali FLU A (IAV) aumentarono considerevolmente. Anche l’incidenza del Covid è aumentata all’aumentare dei tamponi, quando furono liberalizzati.
Invece, cosa succedeva quando non c’era un test specifico? Le ultime pandemie si sono presentate così: “La curva della mortalità per età dell’influenza, che conosciamo per un arco di tempo di circa 150 anni, ha sempre avuto una forma ad U, con mortalità più elevata tra i molto giovani e gli anziani. Invece la curva della mortalità del 1918 [la Spagnola] è stata a W incompleta, simile cioè alla forma ad U, ma con in più un picco di mortalità nelle età centrali tra gli adulti tra 25 e 44 anni.”
Col Covid per la prima volta abbiamo usato un test specifico e i dati sono cambiati, come già mostrato nella figura 7:

Perché questa grande differenza con tutte le passate epidemie?
Considerando un periodo campione, se su 100 pz con sintomi di influenza in media 15,2 risultano positivi, è possibile presumere che molti degli 85 pazienti negativi sarebbero stati erroneamente classificati come positivi in assenza di un test specifico.
Allo stesso modo, senza un tampone specifico per il Covid-19, è probabile che i morti che presentavano sintomi influenzali sarebbero stati attribuiti alla pandemia, invece di essere conteggiati come morti dovute ad altre cause.
Nel passato, attribuire tutte le morti con sintomi simil-influenzali al germe pandemico ha portato alla convinzione che tutti i soggetti fragili, compresi bambini e donne in gravidanza, fossero a rischio durante la pandemia. Invece, le curve di mortalità, letalità e morbilità delle pandemie precedenti differiscono dall’attuale perché, per il Covid-19, sono state conteggiate solo le morti confermate dal test specifico.
In sintesi, la disponibilità di un test specifico ha permesso una diagnosi più accurata e ha contribuito a distinguere le morti e i casi correlati al virus da quelli causati da altre malattie. Questo ha portato a differenze significative nelle statistiche e nell’attribuzione delle morti rispetto alle epidemie passate in cui non c’era un test specifico disponibile.
Uniformare il Modello Standard alle evidenze
Basandoci sulle evidenze derivanti dalle nuove tecnologie, potremmo passare dall’attuale Modello Standard Empirico ad uno Scientifico.
Fin dai tempi di Aristotele nel 400 a.C., si credeva che gli organismi potessero generarsi spontaneamente dalla materia inanimata. Questa teoria, nota come generazione spontanea, è stata accettata per oltre 2000 anni. Nel XIX secolo, Pasteur ha dimostrato attraverso un esperimento del 1861 che i germi hanno una natura biologica e vitale.
Su questa scoperta è stato costruito un modello empirico in cui, sia per gli esseri umani, gli animali o le piante, si partiva dalla malattia per scoprire l’agente che la causava e quindi, basandosi sui sintomi, si formulava una diagnosi; con conseguenze sia sulla tassonomia (i germi prendevano il nome della patologia) che sul modello eziopatogenetico, ad ogni microbo corrispondeva una malattia e viceversa.
Tale impostazione ha permesso di effettuare diagnosi basate sui sintomi, seguendo un ragionamento circolare: ogni germe causa una malattia e ogni malattia è caratterizzata da un insieme di sintomi che differiscono almeno in qualche aspetto dalle altre, consentendo così una diagnosi differenziale e l’adozione di terapie basate sui sintomi. Se i sintomi non sono sufficienti, si può arrivare all’agente attraverso le colture, soprattutto per i batteri.
Con l’avanzare delle conoscenze si è accertato che lo stesso germe può causare malattie diverse, come il rinovirus, che è il più comune fattore nelle infezioni influenzali, mentre lo pneumococco è responsabile di molte meningiti. Inoltre, gli stessi virus possono manifestarsi con sintomi diversi a seconda delle stagioni, come il coronavirus che provoca sintomi simili a un raffreddore durante le stagioni temperate.
Le evidenze mostrano che in molti casi si tratta di coinfezioni e queste dovrebbero essere molte di più rispetto ad infezioni dovute ad un solo germe, in quanto i microbi ancora sconosciuti sono, probabilmente, più numerosi di quelli noti.
Inoltre, la mortalità e morbilità del Covid non è proporzionale alle misure emergenziali adottate ma all’aspettativa di salute della popolazione di ogni Paese.
L’intervento umano viene ridimensionato: dagli antibiotici, che tendono ad eliminare il germe dominante ma possono favorire competitor e varianti resistenti, ai vaccini che agiscono su alcuni ceppi ma non su altri né sui germi coinfettanti; fino al Piano Pandemico: se dei 100 ultranovantenni che contraggono il virus muoiono i 13 con minore aspettativa di salute, più del lockdown, distanziamento, igiene e vaccini serve lo stile di vita contro una pandemia.
Bibliografia
- EpiCentro (2023) Influenza, Vaccini antinfluenzali disponibili. Available at: https://www.epicentro.iss.it/influenza/vaccini-disponibili
- World Health Organization. (2005). WHO global influenza preparedness plan: the role of WHO and recommendations for national measures before and during pandemics. World Health Organization. Available at: https://apps.who.int/iris/handle/10665/68998
- WHO (2017) WHO guidance for surveillance during an influenza pandemic. Available at: https://apps.who.int/iris/bitstream/handle/10665/259886/9789241513333-eng.pdf
- Come funziona l’analisi del Rischio Epidemico (2020) ISS. Available at: https://www.iss.it/coronavirus/-/asset_publisher/1SRKHcCJJQ7E/content/come-funziona-lanalisi-del-rischio-epidemico.
- FAQ Sul calcolo Del Rt (2020) ISS. Available at: https://www.iss.it/covid-19-primo-piano/-/asset_publisher/yX1afjCDBkWH/content/faq-sul-calcolo-del-rt#:~:text=Per%20calcolare%20R0%20o%20Rt,criteri%20sufficientemente%20stabili%20nel%20tempo.
- Luca Ferretti, Alice Ledda, Chris Wymant et al. The timing of COVID-19 transmission. medRxiv preprint doi: https://doi.org/10.1101/2020.09.04.20188516; this version posted September 7, 2020.
- Nickbakhsh, S. et al. (2016) Extensive multiplex PCR diagnostics reveal new insights into the epidemiology of viral respiratory infections, PubMed Central (PMC). Available at: https://www-ncbi-nlm-nih-gov.translate.goog/pmc/articles/PMC7113017/?_x_tr_sl=en&_x_tr_tl=it&_x_tr_hl=it&_x_r_pto=sc.
- Duclos M;Hommel B;Allantaz F;Powell M;Posteraro B;Sanguinetti M; (2022) Multiplex PCR detection of respiratory tract infections in SARS-COV-2-negative patients admitted to the Emergency Department: An international multicenter study during the COVID-19 pandemic, Microbiology spectrum. U.S. National Library of Medicine. Available at: https://pubmed.ncbi.nlm.nih.gov/36154273/.
- Viral aetiology of influenza-like illnesses and severe acute respiratory illnesses in Morocco, September 2014 to December 2016. Abderrahman Bimouhen1,3, Zakia Regragui3, Fatima El Falaki3. https://jogh.org/wp-content/uploads/2022/07/jogh-12-04062.pdf
- Schulz, F. et al. (2020) Giant virus diversity and host interactions through global metagenomics, Nature News. Nature Publishing Group. Available at: https://www.nature.com/articles/s41586-020-1957-x.










